Cómo los anticuerpos de las llamas pueden ayudarnos a luchar contra el coronavirus

Un estudio de Wrapp et al. que se acaba de publicar en Cell demuestra que los anticuerpos de las llamas bloquean el SARS y el SARS-CoV-2, el virus que provoca la COVID-19 (Wrapp et al., 2020). Mientras esto allana el camino para un posible tratamiento para la pandemia global del coronavirus, muchas personas se han quedado con un pregunta:
¿Por qué los anticuerpos de la llama?
Los sistemas inmunológicos de los camélidos son inusuales
Cuenta la leyenda que, a finales de los años 1980, durante una clase de prácticas de laboratorio en la Universidad Libre de Bruselas, se solicitó a los estudiantes que extrajeran anticuerpos de suero sanguíneo humano. Aburridos por este experimento rutinario, los estudiantes empezaron a hurgar por el congelador en busca de muestras más interesantes. Finalmente, se toparon con un muestra de sangre de camello y lo que encontraron cambió el campo de la inmunoterapia para siempre. Junto con las inmunoglobulinas esperadas, se encontraron inesperadamente versiones más pequeñas que no se correspondían con nada conocido por la ciencia hasta el momento. Los investigadores investigaron más exhaustivamente y descubrieron que todos los camélidos (incluidos los dromedarios, las llamas y las alpacas) presentaban unos sistemas inmunológicos inusuales (Gross, 2000).
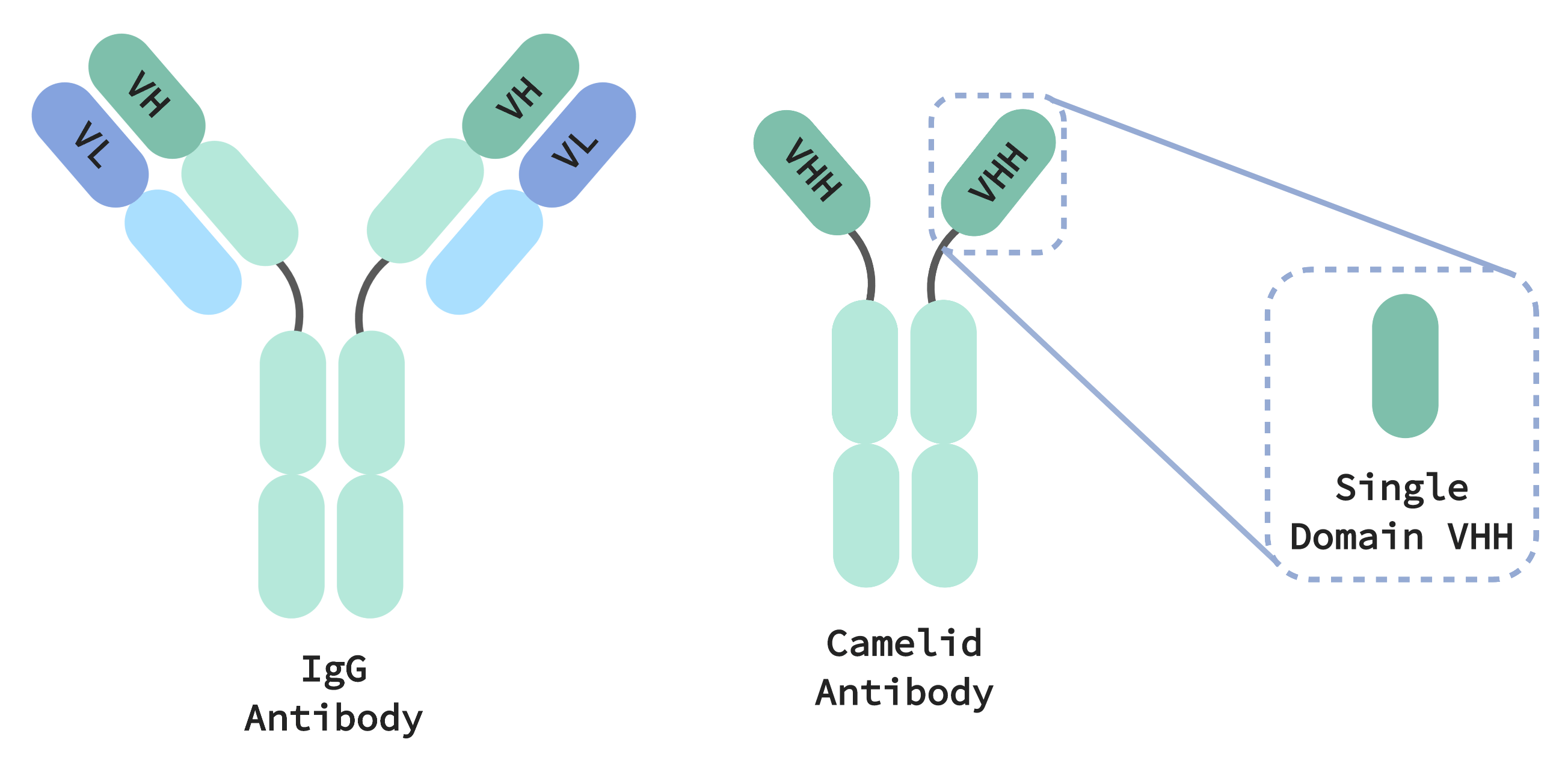
Los sistemas inmunológicos de los camélidos generan anticuerpos más pequeños que son más sencillos y más compactos que los anticuerpos inmunoglobulina G (IgG) presentes en todos los mamíferos. Las IgG están formadas por dos cadenas de proteínas diferentes, pesadas y ligeras, que deben emparejarse y cooperar para reconocer específicamente una diana. Este establecimiento de dianas específico proporciona “memoria” a nuestros sistemas inmunológicos, lo que les permite eliminar de forma selectiva y precisa las amenazas patógenas. Por otro lado, el reconocimiento de dianas por parte de los anticuerpos de los camélidos solo requiere un único dominio de una única cadena de proteínas, denominado VHH (equivalente a la región variable de una cadena pesada en la IgG). Con los anticuerpos basados en VHH capaces de mostrar propiedades farmacéuticamente pertinentes comparables a las IgG, son un tratamiento terapéutico prometedor con varias ventajas con respecto a sus homólogos más complejos y voluminosos.
Por una parte, el pequeño tamaño de los anticuerpos de los camélidos les permite ajustarse a espacios y unirse a partes de moléculas o bloquearlas, que de otra forma serían inaccesibles para los anticuerpos IgG humanos. También son más estables desde una perspectiva térmica y química, lo que convierte a los tratamientos terapéuticos basados en VHH en unos buenos candidatos para tratar infecciones respiratorias, administrados directamente mediante un inhalador en las vías respiratorias, donde la infección se concentra. Al mismo tiempo, estas propiedades proporcionan a las moléculas una larga vida en almacenamiento.
De igual modo, la fabricación de tratamientos terapéuticos basados en VHH también es más sencilla. Los anticuerpos IgG están codificados por dos genes que deben almacenarse, transfectarse y expresarse como un par específico para poder funcionar. Multiplique esto por miles de anticuerpos candidatos y la fabricación de IgG se convertirá muy rápido en un proceso increíblemente complejo desde el punto de vista logístico. Por otro lado, una vez que un anticuerpo VHH candidato esté aislado solo necesitará expresarse por un solo gen, lo que supondrá muchos menos recursos para el seguimiento, el almacenamiento y la experimentación relacionados con estas moléculas. También puede realizarse la expresión de únicamente el dominio VHH, lo que produce moléculas terapéuticas con una décima parte el tamaño de un anticuerpo IgG convencional.
Anticuerpos de las llamas para el tratamiento terapéutico del coronavirus
El año 2020 ha estado dominado por la pandemia de la COVID-19. Hay dos moléculas clave en juego durante la unión inicial del virus SARS-CoV-2 a una célula humana: la proteína S (“espícula”) de unión del dominio del receptor del virus y la angiotensina de la célula anfitriona convertidora de la enzima 2 (ACE2). La proteína espicular se une con firmeza a la ACE2, lo que permite que el virus entre en la célula huésped. El bloqueo de la interacción de estas dos proteínas es un objetivo terapéutico importante. En teoría, un anticuerpo que se una fuertemente a cualquier proteína neutralizaría las partículas del coronavirus, lo que impediría que el virus entrara en nuevas células.
Para descubrir los anticuerpos de los camélidos contra el SARS-CoV-2, Wrapp et al. inmunizaron llamas con una forma estabilizada de una proteína espicular estrechamente relacionada con el SARS. Entre los VHH generados por los sistemas inmunológicos de las llamas, hubo una molécula candidata que se unió con fuerza a la proteína espicular y bloqueó la infección por SARS.
Como el SARS está estrechamente relacionado con el SARS-CoV-2, los investigadores probaron la capacidad de los anticuerpos para desencadenar una reacción cruzada con la proteína espicular equivalente del SARS-CoV-2 . Aunque la interacción inicial fue débil, se creó una versión más fuerte fusionándola con parte de una IgG humana. Esta molécula fusionada pudo neutralizar el SARS-CoV-2 de forma efectiva.
Debido a la escasez de tratamientos profilácticos y terapéuticos disponibles actualmente para combatir la epidemia del coronavirus, se espera que este tratamiento terapéutico basada en los camélidos contribuya tanto a la investigación como al tratamiento de la COVID-19.
Opinión de expertos
"En Twist, valoramos mucho a las llamas, ya que su sistema inmunológico contiene anticuerpos que solo presentan una cadena pesada. Estos anticuerpos VHH o de dominio único son pequeños, fáciles de producir y se unen a sitios específicos, o epitopos, en las dianas de las enfermedades”, indica el Dr. Aaron Sato, director de Estrategia de Twist Biopharma, una división de Twist Bioscience.
“Con estas moléculas en mente, hemos desarrollado un panel de bibliotecas sintéticas de expresión en fagos de anticuerpos VHH derivadas de la diversidad de las secuencias naturales de las llamas”, afirma el Dr. Sato. “Mediante estas bibliotecas, se pueden identificar anticuerpos VHH sin inmunizar llamas y reducir el tiempo hasta su descubrimiento."
Recientemente, el equipo de Twist Biopharma liderado por el Dr. Sato utilizó sus bibliotecas sintéticas de dominio único inspiradas en las llamas para descubrir anticuerpos VHH para ACE2 en menos de seis semanas. Muchos de estos VHH exitosos mostraron una unión potente al receptor e impidieron que la ACE2 se uniera a la proteína S1 del SARS-CoV-2. Este estudio de caso ejemplifica la potencia de estas bibliotecas a la hora de solucionar rápidamente otra diana terapéutica importante para la pandemia de la COVID-19.
Para obtener más información sobre las bibliotecas sintéticas de anticuerpos VHH de Twist Biopharma y cómo se han utilizado para generar tratamientos terapéuticos candidatos contra la COVID-19, haga clic aquí.
Referencias bibliográficas
Wrapp et al., Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid
Antibodies, Cell (2020), https://doi.org/10.1016/j.cell.2020.04.031
Michael Gross, One reason to get the hump, The Guardian (2000), accessed 26th may de 2020, https://www.theguardian.com/science/2000/sep/14/technology1
Foto de cubierta de Jessica Knowlden en Unsplash
¿Qué piensa?
Me gusta
No me gusta
Me encanta
Me asombra
Me interesa
