Wie Lama-Antikörper im Kampf gegen Coronavirus helfen können

Eine kürzlich in Cell veröffentlichte Studie von Wrapp et al. zeigt Antikörper von Lamas, die SARS und SARS-CoV-2 blockieren, das Virus, das COVID-19 verursacht (Wrapp et al., 2020). Dies mag den Weg für eine mögliche Bekämpfung der globalen Coronavirus-Pandemie ebnen; für viele Menschen stellt sich jedoch die Frage:
Warum Lama-Antikörper?
Immunsysteme von Camelidae sind ungewöhnlich
Der Legende nach wurden Studierende der Freien Universität Brüssel Ende der 1980er Jahre während einer Lehrveranstaltung über Laborfähigkeiten mit der Extraktion von Antikörpern aus menschlichem Blutserum beauftragt. Die Studierenden waren bei diesem Routineexperiment gelangweilt und begannen, im Gefrierschrank nach interessanteren Proben zu suchen. Die Studierenden fanden zufällig eine Probe Kamelblut, und was sie dann fanden, veränderte das immuntherapeutische Feld für immer. Neben den erwarteten Immunglobulinen gab es unerwartet kleinere Versionen, die nichts von dem entsprachen, was der Wissenschaft zu diesem Zeitpunkt bekannt war. Die Wissenschaftler untersuchten dies eingehender und fanden heraus, dass alle Camelidae (dazu zählen Dromedare, Lamas und Alpakas) ein ungewöhnliches Immunsystem aufweisen (Gross, 2000).
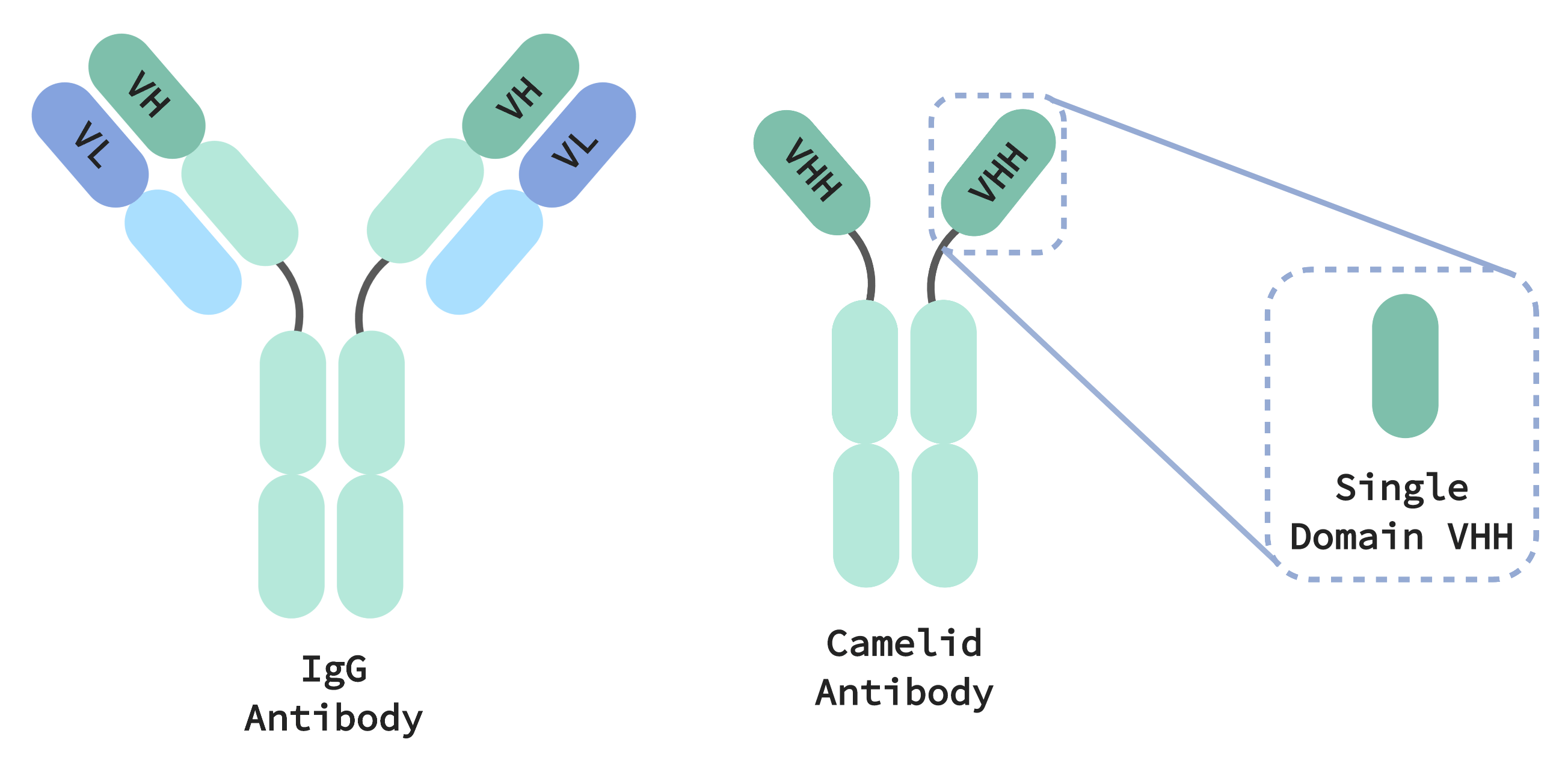
Die Immunsysteme von Camelidae erzeugen kleinere Antikörper, die sowohl einfacher als auch kompakter sind als die IgG-Antikörper, die bei allen Säugetieren vorkommen. IgGs bestehen aus zwei verschiedenen – schweren und leichten – Proteinketten, die sich paaren und zusammenarbeiten müssen, um ein Ziel spezifisch zu erkennen. Dieses spezifische Targeting bietet unserem Immunsystem ein „Gedächtnis“, das ihm ermöglicht, pathogene Bedrohungen selektiv und präzise zu eliminieren. Die Zielerkennung durch Kamelid-Antikörper erfordert andererseits nur eine einzige Domäne, die sich in einer einzelnen, als VHH bezeichneten Proteinkette befindet (entspricht der variablen Region einer schweren Kette in IgG). Mit Antikörpern auf VHH-Basis, die pharmazeutisch relevante, mit IgGs vergleichbare Eigenschaften aufweisen können, sind sie ein vielversprechendes Therapeutikum mit mehreren Vorteilen gegenüber ihren sperrigeren, komplexeren Gegenstücken.
Zum einen bedeutet die geringe Größe von Kamelid-Antikörpern, dass sie sich in Räume drücken und an Teile von Molekülen binden oder blockieren können, die sonst für humane IgG-Antikörper unzugänglich wären. Sie sind auch thermisch und chemisch stabiler, was Therapeutika auf VHH-Basis zu guten Kandidaten für Therapeutika gegen Infektionen der Atemwege macht, wobei die Therapeutika vom Inhalator direkt an die Atemwege verabreicht werden, wo sich die Infektion konzentriert. Gleichzeitig verleihen diese Eigenschaften den Molekülen eine lange Haltbarkeit.
Auch die Herstellung von Therapeutika auf VHH-Basis ist einfacher. IgG-Antikörper werden von zwei Genen codiert, die gespeichert, transfiziert und als spezifisches Paar exprimiert werden müssen, um zu funktionieren. Wird dies mit Tausenden von Antikörperkandidaten multipliziert, dann wird die Herstellung von IgG sehr schnell zu einem unglaublich logistisch komplexen Prozess. Wenn ein VHH-Antikörper-Kandidat einmal isoliert ist, muss er nur noch von einem einzigen Gen exprimiert werden. Dies bedeutet, dass viel weniger Aufwand erforderlich ist, um Experimente mit diesen Molekülen zu verfolgen, zu speichern und durchzuführen. Außerdem ist es möglich, nur die VHH-Domäne zu exprimieren. Dabei werden therapeutische Moleküle erzeugt, die ein Zehntel der Größe eines herkömmlichen IgG-Antikörpers aufweisen.
Lama-Antikörper für Coronavirus-Therapeutika
Das Jahr 2020 wurde von der COVID-19-Pandemie geprägt. Während der anfänglichen Bindung des SARS-CoV-2-Virus an eine menschliche Zelle spielen folgende zwei wichtige Moleküle eine Rolle: das Spike-Protein (S-Protein) der Virusrezeptor-Domäne und das Angiotensin-konvertierende Enzym 2 (ACE2) der Wirtszelle. Das Spike-Protein bindet fest an ACE2 und lässt das Virus in die Wirtszelle eindringen. Die Blockierung der Wechselwirkung dieser beiden Proteine ist ein wichtiges therapeutisches Ziel. Theoretisch würde ein Antikörper, der eines der beiden Proteine fest bindet, Coronavirus-Partikel neutralisieren und das Virus daran hindern, in neue Zellen einzudringen.
Um Kamelid-Antikörper gegen SARS-CoV-2 nachzuweisen, immunisierten Wrapp et al. Lamas mit einer stabilisierten Form des eng verwandten SARS-Spike-Proteins. Unter den vom Lama-Immunsystem erzeugten VHHs befand sich ein Molekül, das fest an das Spike-Protein gebunden war und die SARS-Infektion blockierte.
Da SARS eng mit SARS-CoV-2 verwandt ist, testeten die Wissenschaftler anschließend die Fähigkeit des Antikörpers zur Kreuzreaktion mit dem äquivalenten Spike-Protein von SARS-CoV-2. Während die anfängliche Wechselwirkung schwach war, wurde eine stärkere Version erzeugt, indem sie mit einem Teil eines menschlichen IgG fusioniert wurde. Dieses Fusionsmolekül konnte SARS-CoV-2 effektiv neutralisieren.
Angesichts des Mangels an prophylaktischen und therapeutischen Behandlungen, die derzeit zur Behandlung der Coronavirus-Epidemie verfügbar sind, ist zu hoffen, dass diese auf Kameliden basierenden Therapeutika sowohl zur Erforschung als auch zur Behandlung von COVID-19 beitragen werden.
Expertenmeinung
„Wir bei Twist Bioscience schätzen Lamas sehr, da ihr Immunsystem Antikörper enthält, die nur eine schwere Kette aufweisen. Diese VHH- oder Einzeldomänen-Antikörper sind klein, leicht herzustellen und binden an einzigartige Stellen oder Epitope auf Krankheitszielen“, so Aaron Sato, Ph.D., CSO von Twist Biopharma, einem Geschäftsbereich von Twist Bioscience.
„Unter Berücksichtigung dieser Moleküle haben wir ein Panel synthetischer VHH-Antikörper-Phagen-Display-Bibliotheken entwickelt, die aus der natürlichen Lama-Sequenzdiversität abgeleitet sind“, so Dr. Sato. „Mit diesen Bibliotheken können VHH-Antikörper identifiziert werden, ohne Lamas immunisieren zu müssen, was die Nachweiszeit verkürzt!“
Kürzlich nutzte das Twist Biopharma Team unter der Leitung von Dr. Sato seine vom Lama inspirierten synthetischen Einzeldomänenbibliotheken, um VHH-Antikörper gegen ACE2 in weniger als 6 Wochen nachzuweisen. Viele dieser VHH-Treffer zeigten eine starke Bindung an den Rezeptor und hemmten die Bindung von ACE2 an das SARS-CoV-2-S1-Protein. Diese Fallstudie veranschaulicht die Fähigkeit dieser Bibliotheken, schnell ein weiteres wichtiges therapeutisches Ziel für die COVID-19-Pandemie in Angriff zu nehmen.
Klicken Sie hier, um mehr über die synthetischen VHH-Antikörperbibliotheken von Twist Biopharma und deren Verwendung zur Generierung von COVID-19-Therapeutika zu erfahren.
Literatur
Wrapp et al., Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid
Antibodies, Cell (2020), https://doi.org/10.1016/j.cell.2020.04.031
Michael Gross, One reason to get the hump, The Guardian (2000), accessed 26th Mai 2020, https://www.theguardian.com/science/2000/sep/14/technology1
Titelbild von Jessica Knowlden auf Unsplash
Was denken Sie?
Gefällt mir
Gefällt mir nicht
Gefällt mir sehr
Überraschend
Interessant
